美药厂研发疫苗有进展 将展开更大规模临床测试
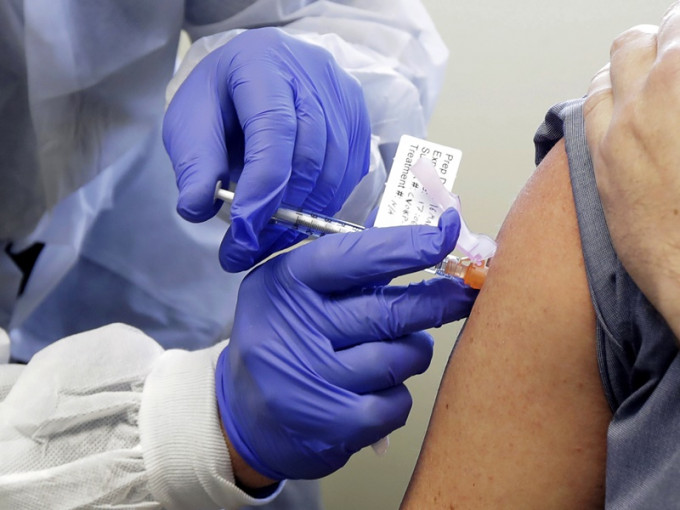
2020-05-19 13:51美国的新冠肺炎累计死亡病例周一突破9万宗,确诊病例则突破150万宗。美国生物科技大厂莫德纳公司(Moderna Inc.)发表报告,指首阶段临床试验结果正面,首批8名志愿者在3月接种疫苗后,产生抗体,测试同时证实疫苗安全,即将展开第2及第3阶段更大规模的临床测试。
莫德纳表示,这种mRNA-1273的疫苗似乎在8名接受测试者体内产生抗体,具有免疫反应,且免疫程度与在新冠肺炎感染者体内观察到的相同。受到消息刺激,道琼斯工业平均指数全日大升逾911点。总统特朗普欢迎有关消息,形容该公司的研究难以置信,已看到成果,而市场亦因此大升。
该公司是于3月开始进行疫苗人体实验,年龄介乎18至55岁。《纽约时报》说,尽管今次实验人体样本数量较少,但市场从中看到快速研发出新冠疫苗的希望,这足以推动股市上升。受利好消息影响,莫德纳公司股价当天上涨近两成。
全球目前超过100款候选疫苗正在研发,至少有8款展开人体试验,mRNA-1273是其中之一。在莫德纳第一阶段的临床实验中,45名临床试验参与者在注射候选疫苗后,体内全都产出新冠病毒抗体。
在临床实验中,受试者分为3组,每组15人,注射的疫苗剂量各为25微克、100微克或250微克,注射完第一剂后,相隔28天再注射第2剂。
研究发现,实验进行到第43天,即注射第2剂两周后,25微克小组的血液样本检测出的结合抗体数量,跟已从新冠肺炎复原者抗体量相同。100微克小组血中的抗体数量更「远超过」复原者。
不只如此,这款疫苗也让至少8名受试者体内产生能对抗新冠病毒的中和抗体。
莫德纳候选疫苗的第2阶段试验已经获得美国食品及药物监督管理局许可,将对600人进行测试,即将在本季度展开。至于最大规模及最重要的第3阶段则会在7月展开。
莫德纳最近才刚跟瑞士药厂Lonza缔结为期10年的合作关系,加快候选疫苗生产。莫德纳行政总裁邦塞尔(Stephane Bancel)表示,希望最快7月就可以开始生产候选疫苗。他说:「我们的团队只要一取得许可,就会开始作业。」他并说,跟Lonza合作后,每年的疫苗产能上看1亿剂。







最新回应